
CRI是监管情报一体化来源,可用于监控法规变更,了解申请提交途径和当地惯例,比较各国的监管要求以及进行上市前和上市后监测。数据库涵盖80多个国家/地区,232,000多份药物、生物制品、医疗器械和体外诊断试剂(IVD)的法规文件,3,000多份关键文件进行独家英文翻译,整合5,000多份监管机构现场检查文件。
• 多国对比:快速比较不同国家的药政法规异同
• 药政专题情报报告:立法追踪,产品批准、公众评议、监管检查等追踪报告,为监管审查、沟通会议做好充分准备
• 各国药政总结报告:了解不同国家/地区对于不同类型产品研发到上市后管理整个生命周期的法规要求和本地实践专家总结
• 原始文件汇编:浏览最新/历史存档的药政法规文件
访问方式:个人试用账号密码登录。如需试用,请扫描下方二维码提交试用申请。填写申请表后,几个数据库一起开通试用。

微信扫描二维码,提交个人信息开通试用
试用期限:本年度内可随时申请试用,账号申请开通后可试用14天。
说明:试用账号无下载导出功能。
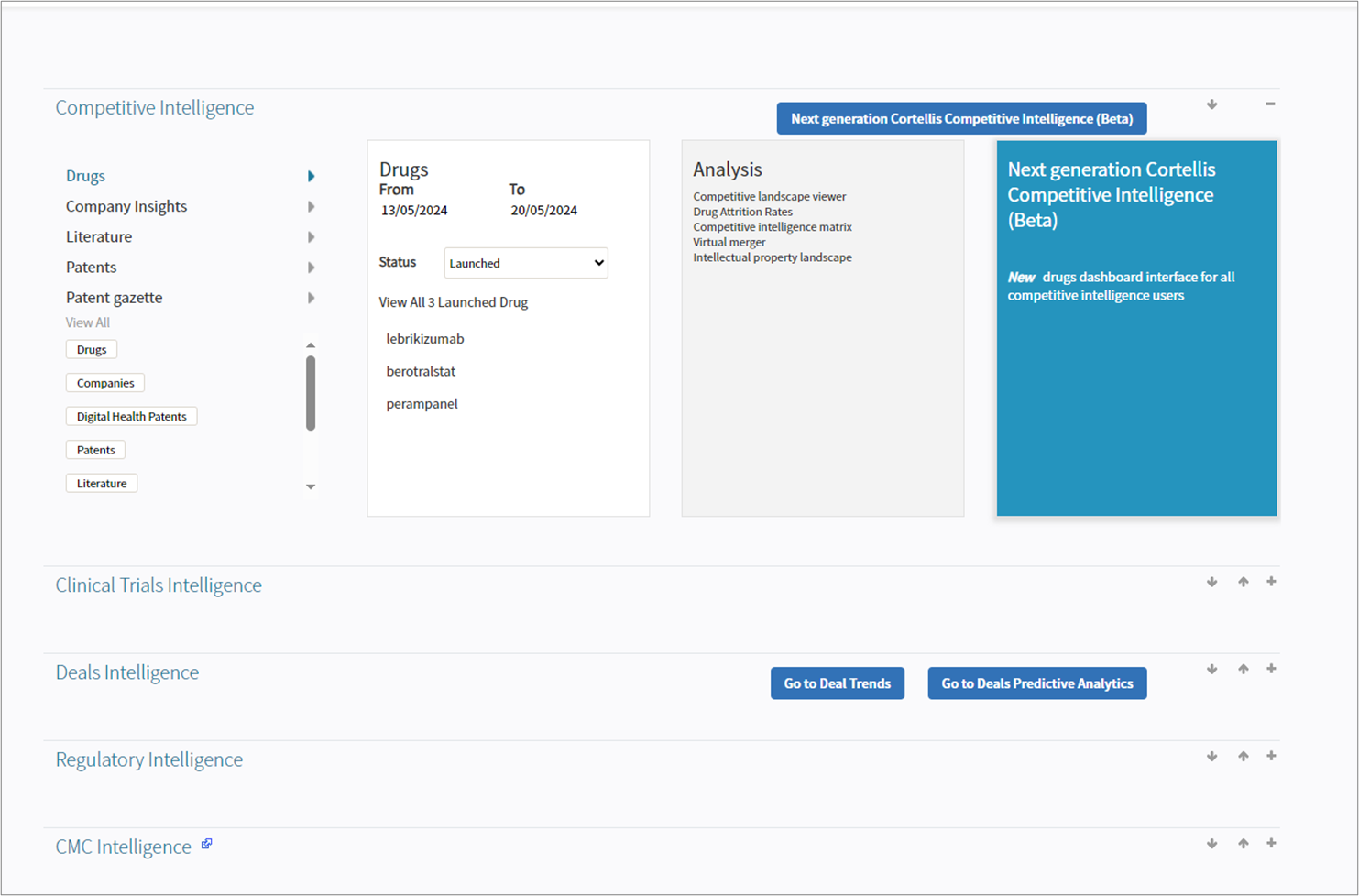
CCI登录后页面示意图,包括CTI、CDI、CRI跳转链接